 |
Художник Макс
Эрнст
|
Сверхзадача
Сахарный диабет относится к числу заболеваний, которые, несмотря на все усилия, победить пока не удается. От него в той или иной степени страдают 422 млн человек, а к 2030 году число заболевших, по прогнозам специалистов, достигнет 552 млн («Frontiers in Genetics», 2017, doi: 10.3389/fgene.2017.00075, полный текст).
Сахарный диабет подразделяют на два типа. Диабет первого типа (СД1) — аутоиммунное заболевание, при котором избирательно разрушаются β-клетки поджелудочной железы, синтезирующие инсулин. Нехватка этого гормона приводит к хронической гипергликемии (повышенному уровню глюкозы в крови). Основное и довольно эффективное лекарство от СД1 — инсулиновые инъекции, которые, однако, не решают проблему, поскольку пациенты все равно живут меньше здоровых людей и качество жизни у них не очень хорошее.
Диабет второго типа (СД2) начинается с того, что клетки печени, мышц, жировой ткани приобретают устойчивость к инсулину. В результате в крови возрастают концентрации глюкозы и свободных жирных кислот, поскольку инсулин влияет на углеводный и жировой обмен. Бета-клетки воспринимают эти изменения как результат нехватки инсулина и с удвоенной энергией принимаются за его синтез. Длительная, экстремальная и, увы, бесплодная активность приводит к дисфункции клеток и, возможно, к их гибели, тем более что они и сами страдают от инсулиновой резистентности. Недавно исследователи выяснили, что в β-клетках больных СД2 не работают ключевые факторы транскрипции, в результате клетки перестают синтезировать инсулин («Cell Metabolism» 2018, doi: 10.1016/j.cmet.2018.04.013, полный текст в PDF).
Так и получается, что при разном патогенезе СД1 и СД2 последствия у них сходные: гипергликемия и истощение пула β-клеток. И если не обеспечить пациента должным количеством клеток, способных реагировать на изменение концентрации глюкозы и синтезировать инсулин, вылечить его не удастся. В тяжелых случаях больным СД1 делают пересадку донорских β-клеток, однако это дорогая и сложная процедура, чреватая многими побочными эффектами. Человек, перенесший трансплантацию, обречен на пожизненный прием лекарств.
Есть и другая возможность восстановить утраченные β-клетки — заставить их образовываться в организме пациента. Именно этот путь выбрали французские исследователи из университета Ниццы — Софии Антиполис под руководством Патрика Колломбá. Ученые более 15 лет исследуют особенности дифференцировки эндокринных клеток поджелудочной железы и, возможно, нашли достаточно простой метод управлять этим процессом.
Сахарный диабет подразделяют на два типа. Диабет первого типа (СД1) — аутоиммунное заболевание, при котором избирательно разрушаются β-клетки поджелудочной железы, синтезирующие инсулин. Нехватка этого гормона приводит к хронической гипергликемии (повышенному уровню глюкозы в крови). Основное и довольно эффективное лекарство от СД1 — инсулиновые инъекции, которые, однако, не решают проблему, поскольку пациенты все равно живут меньше здоровых людей и качество жизни у них не очень хорошее.
Диабет второго типа (СД2) начинается с того, что клетки печени, мышц, жировой ткани приобретают устойчивость к инсулину. В результате в крови возрастают концентрации глюкозы и свободных жирных кислот, поскольку инсулин влияет на углеводный и жировой обмен. Бета-клетки воспринимают эти изменения как результат нехватки инсулина и с удвоенной энергией принимаются за его синтез. Длительная, экстремальная и, увы, бесплодная активность приводит к дисфункции клеток и, возможно, к их гибели, тем более что они и сами страдают от инсулиновой резистентности. Недавно исследователи выяснили, что в β-клетках больных СД2 не работают ключевые факторы транскрипции, в результате клетки перестают синтезировать инсулин («Cell Metabolism» 2018, doi: 10.1016/j.cmet.2018.04.013, полный текст в PDF).
Так и получается, что при разном патогенезе СД1 и СД2 последствия у них сходные: гипергликемия и истощение пула β-клеток. И если не обеспечить пациента должным количеством клеток, способных реагировать на изменение концентрации глюкозы и синтезировать инсулин, вылечить его не удастся. В тяжелых случаях больным СД1 делают пересадку донорских β-клеток, однако это дорогая и сложная процедура, чреватая многими побочными эффектами. Человек, перенесший трансплантацию, обречен на пожизненный прием лекарств.
Есть и другая возможность восстановить утраченные β-клетки — заставить их образовываться в организме пациента. Именно этот путь выбрали французские исследователи из университета Ниццы — Софии Антиполис под руководством Патрика Колломбá. Ученые более 15 лет исследуют особенности дифференцировки эндокринных клеток поджелудочной железы и, возможно, нашли достаточно простой метод управлять этим процессом.
 |
Рис.1. Фрагмент поджелудочной железы:
островок
Лангерганса в окружении ацинусов
|
Итак, поджелудочная железа (рис.1). Она синтезирует пищеварительные ферменты и работает как железа внутренней секреции. Клетки, выделяющие ферменты, сгруппированы вокруг выводящих протоков и образуют структуру, которая называется ацинус. Эндокринные клетки собраны в небольшие кластеры — островки Лангерганса, расположенные между ацинусами. Известно пять типов этих клеток: α, β, δ, ε и РР (произносится «пп»). Нас сейчас интересуют α-клетки, которые синтезируют глюкагон, и β-клетки, выделяющие инсулин. Глюкагон повышает содержание глюкозы и свободных жирных кислот в крови, инсулин концентрацию глюкозы снижает.
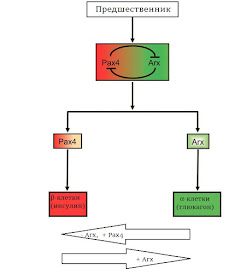 |
Рис.2. Гены Arx и Pax4 определяют специализацию эндокринных
клеток поджелудочной железы. Изменяя активность этих генов, можно
перепрограммировать зрелые клетки.
|
У эндокринных клеток общий предшественник, а их дальнейшая специализация зависит от того, какие именно гены в клетке заработают. Таких специфических последовательностей известно несколько, ученые сосредоточили внимание на двух: Arx и Pax4 (рис. 2). Это факторы транскрипции, то есть они регулируют работу других генов. Друг друга они взаимно подавляют: продукт Arx тормозит работу Pax4, и наоборот. Еще в 2003 году, работая на мышах, группа Патрика Колломба выяснила, что Arx обеспечивает дифференцировку по α-пути, а Pax4 отвечает за образование β-клеток. Если Arx вдруг заработает в зрелых β-клетках, они превратятся в α-клетки: перестанут выделять инсулин и приступят к синтезу глюкагона. Получив такой результат, ученые попробовали совершить обратное действие: превратить функциональные глюкагоновые клетки в инсулиновые. Для этого они заставляли Pax4 работать в α-клетках или отключали в них ген Arx. И все удалось! Причем главным триггером превращения α- в β- была именно пониженная активность Arx, а роль Pax4 сводится к тому, чтобы мешать работе Arx. Зрелые эндокринные клетки островков Лангерганса оказались гораздо пластичнее, чем можно было ожидать («Developmental Cell», 2013, doi: 10.1016/j.devcel.2013.05.018, полный текст).
Трансформацию эндокринных клеток исследовали на специально созданных трансгенных линиях мышей. Экспериментаторы могли включать ген Pаx4 в глюкагоновых клетках, давая мышам доксициклин. С больными сахарным диабетом так обойтись не удастся, им подавай таблетки, в крайнем случае, уколы. Хотя ученые и доказали, что инсулиновые клетки можно получить из глюкагоновых, этот результат, сам по себе интересный и многообещающий, неприменим на практике. Для клинического использования необходимо было найти соединение, без трансгенеза изменяющее активность Arx и Pax4 в α-клетках. И такое вещество нашли, даже не одно.
Трансформацию эндокринных клеток исследовали на специально созданных трансгенных линиях мышей. Экспериментаторы могли включать ген Pаx4 в глюкагоновых клетках, давая мышам доксициклин. С больными сахарным диабетом так обойтись не удастся, им подавай таблетки, в крайнем случае, уколы. Хотя ученые и доказали, что инсулиновые клетки можно получить из глюкагоновых, этот результат, сам по себе интересный и многообещающий, неприменим на практике. Для клинического использования необходимо было найти соединение, без трансгенеза изменяющее активность Arx и Pax4 в α-клетках. И такое вещество нашли, даже не одно.
Решения
После того как трансгенные мыши три месяца получали доксициклин и генерировали инсулиновые клетки, ученые проверили, как при этом изменяется генная активность в островках Лангерганса. Наивно было бы ожидать, что дело ограничится генами инсулина, глюкагона и двух факторов транскрипции. Для ответа на этот вопрос проанализировали транскриптом — совокупность клеточных РНК. Оказалось, что в ходе α→β -трансформации в эндокринных клетках в несколько раз выросла активность генов рецепторов γ-аминомасляной кислоты (ГАМК), декарбоксилазы глутаминовой кислоты — фермента, который регулирует синтез ГАМК в β-клетках, и гефирина. Гефирин — белок, воспринимающий и усиливающий сигналы, поступающие на один из рецепторов γ-аминомасляной кислоты — ГАМКА-рецептор. Иными словами, активировался сигнальный путь ГАМК. Следовательно, имело смысл проверить, как это вещество влияет на α→β-трансформацию («Cell», 2017, doi:10.1016/j.cell.2016.11.002, полный текст).
ГАМК — распространенная сигнальная молекула, которая образуется в самых разных клетках. В поджелудочной железе ее синтезируют β-клетки. Молекула регулирует секрецию гормонов поджелудочной железы и служит сигналом между β- и другими эндокринными клетками. Кровь в островках Лангерганса циркулирует так, что сначала омывает инсулиновые клетки и принимает от них инсулин и ГАМК, которые переносит к α-клеткам. ГАМК, в том числе, подавляет секрецию глюкагона. Если сигнал будет очень силен, дело может дойти до утраты клеточной идентичности. Кислота действует на α-клетки преимущественно через рецепторы ГАМКА. Это специфические рецепторы, в мышиных β-клетках их практически нет.
Ученым предстояло выяснить, вызывает ли ГАМК α→β-трансформацию, насколько эффективно такое лечение и сколь длительным оно может быть. Работать начали со здоровыми взрослыми мышами, которым в течение одного — шести месяцев ежедневно делали внутрибрюшинные инъекции ГАМК. Животные оставались здоровыми, плодовитыми, на жизнеспособности, весе и уровне глюкозы в крови эта процедура не сказалась, устойчивость к инсулину мыши не приобрели. Однако в поджелудочной железе увеличилось число островков Лангерганса и их размер. Островки разрослись, потому что умножилось количество инсулиновых клеток, их объем остался прежним. Эффект зависел от длительности курса и дозы ГАМК. Новообразованные β-клетки располагались в «неправильных» местах, ближе к протокам железы, хотя им положено быть в центре островка.
Иммуногистохимический анализ подтвердил, что под действием ГАМК из дифференцированных α-клеток здоровых мышей получаются полноценные β-клетки, которые перестают синтезировать глюкагон и начинают секретировать инсулин. А как обстоит дело у больных?
И мышам ввели токсичный для β-клеток стрептозотоцин. Когда клетки погибли и у животных развился сахарный диабет, им стали делать ежедневные инъекции ГАМК или физиологического раствора. У контрольных мышей болезнь прогрессировала, и спустя три недели уровень глюкозы шестикратно превышал норму. К этому времени животные погибали. У мышей, которых лечили ГАМК, уровень глюкозы сначала рос с той же скоростью, что и у контрольных животных, но они выжили, а через три месяца концентрация глюкозы практически нормализовалась и численность β-клеток восстановилась. Никаких других лекарств мыши не получали, одной ГАМК оказалось достаточно, чтобы вылечить животных, причем терапию начали, когда болезнь уже далеко зашла.
ГАМК — распространенная сигнальная молекула, которая образуется в самых разных клетках. В поджелудочной железе ее синтезируют β-клетки. Молекула регулирует секрецию гормонов поджелудочной железы и служит сигналом между β- и другими эндокринными клетками. Кровь в островках Лангерганса циркулирует так, что сначала омывает инсулиновые клетки и принимает от них инсулин и ГАМК, которые переносит к α-клеткам. ГАМК, в том числе, подавляет секрецию глюкагона. Если сигнал будет очень силен, дело может дойти до утраты клеточной идентичности. Кислота действует на α-клетки преимущественно через рецепторы ГАМКА. Это специфические рецепторы, в мышиных β-клетках их практически нет.
Ученым предстояло выяснить, вызывает ли ГАМК α→β-трансформацию, насколько эффективно такое лечение и сколь длительным оно может быть. Работать начали со здоровыми взрослыми мышами, которым в течение одного — шести месяцев ежедневно делали внутрибрюшинные инъекции ГАМК. Животные оставались здоровыми, плодовитыми, на жизнеспособности, весе и уровне глюкозы в крови эта процедура не сказалась, устойчивость к инсулину мыши не приобрели. Однако в поджелудочной железе увеличилось число островков Лангерганса и их размер. Островки разрослись, потому что умножилось количество инсулиновых клеток, их объем остался прежним. Эффект зависел от длительности курса и дозы ГАМК. Новообразованные β-клетки располагались в «неправильных» местах, ближе к протокам железы, хотя им положено быть в центре островка.
Иммуногистохимический анализ подтвердил, что под действием ГАМК из дифференцированных α-клеток здоровых мышей получаются полноценные β-клетки, которые перестают синтезировать глюкагон и начинают секретировать инсулин. А как обстоит дело у больных?
И мышам ввели токсичный для β-клеток стрептозотоцин. Когда клетки погибли и у животных развился сахарный диабет, им стали делать ежедневные инъекции ГАМК или физиологического раствора. У контрольных мышей болезнь прогрессировала, и спустя три недели уровень глюкозы шестикратно превышал норму. К этому времени животные погибали. У мышей, которых лечили ГАМК, уровень глюкозы сначала рос с той же скоростью, что и у контрольных животных, но они выжили, а через три месяца концентрация глюкозы практически нормализовалась и численность β-клеток восстановилась. Никаких других лекарств мыши не получали, одной ГАМК оказалось достаточно, чтобы вылечить животных, причем терапию начали, когда болезнь уже далеко зашла.
Примечательно, что поджелудочная железа при этом не оскудевает α-клетками: трансформируясь в β-клетки, они компенсируют убыль в своих рядах за счет эпителия, выстилающего протоки (рис. 3). Потеря α-клеток и, соответственно, запасов гликогена запускает компенсаторные механизмы, эпителиальные клетки дедифференцируются и превращаются в эндокринные. При длительном воздействии ГАМК новые α-клетки также будут превращаться в β-клетки, численность которых со временем возрастает. Интересно, что количество островков Лангерганса увеличивается не более чем в два раза, так что индуцированный неогенез β-клеток лимитирован.
ГАМК-терапия имеет два существенных достоинства. Прежде всего, восстановительных циклов может быть несколько. Мышам, у которых β-клетки успешно регенерировали, перестали давать ГАМК, а спустя месяц ввели стрептозотоцин повторно. Заболевших животных опять разделили на контрольных и подопытных; контрольные быстро умерли от острой гипергликемии, а у подопытных ГАМК нормализовала уровень глюкозы в крови. Второе преимущество заключается в том, что возраст лечению не помеха: десятимесячные старые мыши реагируют на него так же, как животные двух с половиной месяцев от роду. Кроме того, это контролируемый процесс, который не вызывает устойчивости к инсулину и не нарушает гомеостаз глюкозы.
Но это у мышей. А как обстоят дела у человека? Пока ученые поработали только с клеточными культурами. Они использовали островки Лангерганса людей, умерших от повреждений мозга. Клетки пересаживали под почечную капсулу иммунодефицитным мышам, которым затем ежедневно в течение месяца вводили ГАМК. В трансплантатах количество эндокринных клеток возросло в 1,2 раза, а число α+β — в 1,9 раз по сравнению с контрольными животными, которым вводили физиологический раствор. Важно, что число глюкагоновых клеток снизилось в 3,8 раза, а число инсулиновых увеличилось в 1,4 раза. Следовательно, α-клетки человека под действием ГАМК могут превращаться в клетки, синтезирующие инсулин.
Второе лекарство, вызывающее α→β-трансформацию, — артеметер, антималярийный препарат из группы артемизининов. Его французские исследователи отыскали совместно с австрийскими учеными под руководством Стефана Кубичека («Cell», 2017, doi:10.1016/j.cell.2016.11.010, полный текст).
Исследователи испытали лекарство на рыбках данио. От пятидневной обработки артеметером размер их островков увеличился, а количество α-клеток сократилось. Эффект препарата зависел от дозы. У данио с нехваткой β-клеток лекарство за четыре дня увеличивало их число на 75% и снизило уровень глюкозы в рыбьей крови.
У здоровых мышей островки Лангерганса тоже разрослись, и α-клетки превращались в β. Только мышам давали не артеметер, а другое производное артемизинина — артесунат. Мыши принимали его три месяца.
В культуре α-клеток человека под действием препарата начинается синтез инсулина.
Чтобы артемизинин подействовал, на ГАМКА должен поступать сигнал. Обычно он приходит от β-клеток при высоком содержании глюкозы и предотвращает синтез глюкагона в α-клетках . Если воздействовать на клетки ГАМК, сигнал будет сильным, белок ARX перестанет выполнять свои функции, и глюкагоновые клетки превратятся в инсулиновые. Если ГАМК мало и сигнал слаб, артеметер его усиливает. Это объяснение приблизительное и предварительное. Чтобы расшифровать молекулярные механизмы α→β-трансформации, требуются дальнейшие исследования.
Вообще, работы еще непочатый край. Однако это не мешает ученым мечтать о пищевых добавках, содержащих ГАМК, и использовании производных артемизинина для лечения сахарного диабета (производных, кстати, несколько, и не все они вызывают неогенез β-клеток). Поскольку артеметер — официально признанный, безопасный для человека препарат, это должно упростить процедуру его внедрения.
У исследователей есть основания для оптимизма, но и для сомнений поводов достаточно. Причем в роли скептиков выступают сами ученые.
ГАМК-терапия имеет два существенных достоинства. Прежде всего, восстановительных циклов может быть несколько. Мышам, у которых β-клетки успешно регенерировали, перестали давать ГАМК, а спустя месяц ввели стрептозотоцин повторно. Заболевших животных опять разделили на контрольных и подопытных; контрольные быстро умерли от острой гипергликемии, а у подопытных ГАМК нормализовала уровень глюкозы в крови. Второе преимущество заключается в том, что возраст лечению не помеха: десятимесячные старые мыши реагируют на него так же, как животные двух с половиной месяцев от роду. Кроме того, это контролируемый процесс, который не вызывает устойчивости к инсулину и не нарушает гомеостаз глюкозы.
Но это у мышей. А как обстоят дела у человека? Пока ученые поработали только с клеточными культурами. Они использовали островки Лангерганса людей, умерших от повреждений мозга. Клетки пересаживали под почечную капсулу иммунодефицитным мышам, которым затем ежедневно в течение месяца вводили ГАМК. В трансплантатах количество эндокринных клеток возросло в 1,2 раза, а число α+β — в 1,9 раз по сравнению с контрольными животными, которым вводили физиологический раствор. Важно, что число глюкагоновых клеток снизилось в 3,8 раза, а число инсулиновых увеличилось в 1,4 раза. Следовательно, α-клетки человека под действием ГАМК могут превращаться в клетки, синтезирующие инсулин.
Второе лекарство, вызывающее α→β-трансформацию, — артеметер, антималярийный препарат из группы артемизининов. Его французские исследователи отыскали совместно с австрийскими учеными под руководством Стефана Кубичека («Cell», 2017, doi:10.1016/j.cell.2016.11.010, полный текст).
Артемизинин изготавливают из полыни однолетней (Artemisia annua), в честь которой он и назван. За его открытия китайский фармаколог Ту Юю в 2015 году получила половину Нобелевской премии по физиологии и медицине. Артеметер — полусинтетическое производное артемизинина, его жирорастворимый метиловый эфир. Артеметер взаимодействует с гефирином — белком, непосредственно связанным с рецептором к ГАМК на мембране α-клеток. Гефирин усиливает сигналы ГАМК, поступающие на рецептор, артеметер увеличивает уровень гефирина в α-клетках. Взаимодействие лекарства с гефирином вызывает перемещение белка Arx из ядра в цитоплазму, где он не может влиять на работу гена Pax4, клетка прекращает синтезировать глюкагон и начинает синтезировать инсулин (рис. 4).
Исследователи испытали лекарство на рыбках данио. От пятидневной обработки артеметером размер их островков увеличился, а количество α-клеток сократилось. Эффект препарата зависел от дозы. У данио с нехваткой β-клеток лекарство за четыре дня увеличивало их число на 75% и снизило уровень глюкозы в рыбьей крови.
У здоровых мышей островки Лангерганса тоже разрослись, и α-клетки превращались в β. Только мышам давали не артеметер, а другое производное артемизинина — артесунат. Мыши принимали его три месяца.
В культуре α-клеток человека под действием препарата начинается синтез инсулина.
Чтобы артемизинин подействовал, на ГАМКА должен поступать сигнал. Обычно он приходит от β-клеток при высоком содержании глюкозы и предотвращает синтез глюкагона в α-клетках . Если воздействовать на клетки ГАМК, сигнал будет сильным, белок ARX перестанет выполнять свои функции, и глюкагоновые клетки превратятся в инсулиновые. Если ГАМК мало и сигнал слаб, артеметер его усиливает. Это объяснение приблизительное и предварительное. Чтобы расшифровать молекулярные механизмы α→β-трансформации, требуются дальнейшие исследования.
Вообще, работы еще непочатый край. Однако это не мешает ученым мечтать о пищевых добавках, содержащих ГАМК, и использовании производных артемизинина для лечения сахарного диабета (производных, кстати, несколько, и не все они вызывают неогенез β-клеток). Поскольку артеметер — официально признанный, безопасный для человека препарат, это должно упростить процедуру его внедрения.
У исследователей есть основания для оптимизма, но и для сомнений поводов достаточно. Причем в роли скептиков выступают сами ученые.
Сомнения
Основной и пока неразрешимый вопрос заключается в том, почему возникла такая удивительная пластичность, позволяющая зрелым α-клеткам превращаться в β-клетки, и как поддерживается такой механизм? Ведь в естественных условиях он, по-видимому, не работает, α→β-трансформация при сахарном диабете не происходит. Можно, конечно, поспекулировать на эту тему, однако исследователи признают, что не вполне понимают, какие именно внутриклеточные изменения, связанные с диабетом (локальная концентрация ГАМК, инсулина или глюкагона, набор субъединиц ГАМК-рецепторов или другие факторы), влияют на секреторную активность клеток.
Интересно еще вот что. Ежегодно больные малярией используют более 300 млн доз артемизинина и его производных. При этом, несмотря на значительную когорту пациентов, клинических данных о действии артемизининов на эндокринную функцию поджелудочной железы человека нет. Ученые предлагают несколько объяснений.
Малярийный плазмодий вызывает гипогликемию, при острых тяжелых случаях заболевания уровень глюкозы меняется очень быстро и может маскировать эффекты лекарства. Кроме того, у людей со здоровой поджелудочной железой небольшое увеличение числа β-клеток не должно приводить к дополнительной секреции инсулина, поскольку его синтез зависит от уровня глюкозы в крови. Если пациент не страдает гипергликемией, неогенез β-клеток останется незамеченным, а простых методов, позволяющих непосредственно определить массу β-клеток, нет.
Влияние артемизинина на α-клетки может зависеть от длительности лечения. При экспериментах на клеточных линиях, изолированных островках Лангерганса и юных данио, которых просто помещали в лекарственную среду, эффект наступал через несколько часов или дней. Однако изменения у грызунов занимают уже недели и месяцы, возможно, из-за низкой биодоступности артемизининов in vivo. Время полужизни этих соединений в плазме крови колеблется от минут до нескольких часов, они плохо растворяются в водных растворах, мышам их дают перорально раз в день. А больные малярией обычно принимают артемизинины только четыре дня, но каждые восемь часов, причем в больших дозах.
Сейчас проходят клинические исследования влияния длительного приема артемизининов на онкологических больных. Следовательно, и клинические испытания препаратов, влияющих на экспрессию инсулина у больных сахарным диабетом обоих типов, в принципе возможны. И тогда мы все узнаем.
Однако нельзя забывать, что СД1 — аутоиммунное заболевание. Допустим, ГАМК, артеметер или какое-нибудь другое лекарство превратит α-клетки в β-, а иммунные клетки будут их по-прежнему убивать. Будет ли толк от такого лечения? Патрик Колломба видит четыре возможных способа решения проблемы.
Лекарство окажется эффективным, если новообразованные β-подобные клетки будут сохранять некоторые α-черты, которые защитят их от атак иммунной системы. Вероятность довольно высока, известно, например, что α-клетки более, чем β-, устойчивы к апоптозу, вызванному некоторыми вирусами и метаболическим стрессом.
Можно надеяться, что неогенез β-клеток будет происходить быстрее, чем их потеря, потому что СД1 прогрессирует медленно. Секреция инсулина у людей с иммунологическими нарушениями снижается задолго до развития настоящего диабета.
Есть вероятность, что ГАМК или другое лекарство хотя бы отчасти защитит клетки от активности иммунной системы. Кроме того, при лечении СД1 можно сочетать ГАМК или артемизинин с иммунокорректорами. Лекарства будут возобновлять пул β-клеток, а иммунокорректоры их защищать. Не исключено также, что в ходе неизбежных дальнейших исследований откроются новые возможности.
Reznik N.L.
Интересно еще вот что. Ежегодно больные малярией используют более 300 млн доз артемизинина и его производных. При этом, несмотря на значительную когорту пациентов, клинических данных о действии артемизининов на эндокринную функцию поджелудочной железы человека нет. Ученые предлагают несколько объяснений.
Малярийный плазмодий вызывает гипогликемию, при острых тяжелых случаях заболевания уровень глюкозы меняется очень быстро и может маскировать эффекты лекарства. Кроме того, у людей со здоровой поджелудочной железой небольшое увеличение числа β-клеток не должно приводить к дополнительной секреции инсулина, поскольку его синтез зависит от уровня глюкозы в крови. Если пациент не страдает гипергликемией, неогенез β-клеток останется незамеченным, а простых методов, позволяющих непосредственно определить массу β-клеток, нет.
Влияние артемизинина на α-клетки может зависеть от длительности лечения. При экспериментах на клеточных линиях, изолированных островках Лангерганса и юных данио, которых просто помещали в лекарственную среду, эффект наступал через несколько часов или дней. Однако изменения у грызунов занимают уже недели и месяцы, возможно, из-за низкой биодоступности артемизининов in vivo. Время полужизни этих соединений в плазме крови колеблется от минут до нескольких часов, они плохо растворяются в водных растворах, мышам их дают перорально раз в день. А больные малярией обычно принимают артемизинины только четыре дня, но каждые восемь часов, причем в больших дозах.
Сейчас проходят клинические исследования влияния длительного приема артемизининов на онкологических больных. Следовательно, и клинические испытания препаратов, влияющих на экспрессию инсулина у больных сахарным диабетом обоих типов, в принципе возможны. И тогда мы все узнаем.
Однако нельзя забывать, что СД1 — аутоиммунное заболевание. Допустим, ГАМК, артеметер или какое-нибудь другое лекарство превратит α-клетки в β-, а иммунные клетки будут их по-прежнему убивать. Будет ли толк от такого лечения? Патрик Колломба видит четыре возможных способа решения проблемы.
Лекарство окажется эффективным, если новообразованные β-подобные клетки будут сохранять некоторые α-черты, которые защитят их от атак иммунной системы. Вероятность довольно высока, известно, например, что α-клетки более, чем β-, устойчивы к апоптозу, вызванному некоторыми вирусами и метаболическим стрессом.
Можно надеяться, что неогенез β-клеток будет происходить быстрее, чем их потеря, потому что СД1 прогрессирует медленно. Секреция инсулина у людей с иммунологическими нарушениями снижается задолго до развития настоящего диабета.
Есть вероятность, что ГАМК или другое лекарство хотя бы отчасти защитит клетки от активности иммунной системы. Кроме того, при лечении СД1 можно сочетать ГАМК или артемизинин с иммунокорректорами. Лекарства будут возобновлять пул β-клеток, а иммунокорректоры их защищать. Не исключено также, что в ходе неизбежных дальнейших исследований откроются новые возможности.
Reznik N.L.


