Электронная
микроскопия дает ученым возможность заглянуть внутрь клетки, которую можно
представить в виде Вселенной в миниатюре. И наши познания о ней также не имеют
конца, как и познания о Космосе. Тем сильнее наше стремление заглянуть глубже и
познать больше. С помощью современных оптических микроскопов ученые могут
видеть только такие крупные компоненты клетки, как митохондрии и ядро. Но когда
на помощь приходит сканирующая электронная и атомно-силовая микроскопия, то
пытливому глазу исследователя становятся доступны объекты размером в несколько
нанометров...
 |
|
Слева: дрожжевая
клетка с удаленным фрагментом клеточной оболочки. Видно округлое ядрои
цитоплазматические структуры. Справа:
дрожжевые клетки под световым микроскопом. Стрелками показаны почкующиеся
дрожжи.
|
В настоящее время электронная микроскопия (ЭМ) нашла широкое применение в микробиологии, вирусологии, биохимии, онкологии, медицинской генетике и иммунологии. Благодаря ЭМ раскрыта субмикроскопическая структура клеток, открыт ряд неизвестных ранее клеточных органелл, таких как лизосомы, рибосомы, эндоплазматический ретикулум, микротрубочки, цитоскелет и прочие структуры, специфичные для разных видов клеток. Электронная микроскопия позволила понять многие тонкие механизмы развития болезней, в том числе на ранних этапах их возникновения, еще до появления четкой клинической симптоматики.
 |
|
Гипотетическая схема строения клеточного ядра
|
К сожалению, просвечивающая электронная микроскопия ограничена в своих возможностях по исследованию и диагностике поверхности клеточных структур, и лет пятнадцать назад вопрос о том, как заглянуть внутрь ядра и получить трехмерное изображение внутриядерных и околоядерных структур, был неразрешим. Дело в том, что тонкие срезы ткани, которые изучаются под микроскопами, являются двумерными срезами и не позволяют судить о трехмерной структуре клеточных компонентов. Трехмерное изображение можно получить после реконструкции сотен серийных срезов, но это длительный и трудоемкий процесс.
 |
|
«Мембранная
рапсодия».
Мембранные
компоненты эндоплазматического ретикулума на поверхности ядра ооцита лягушки.
Эндоплазматический ретикулум (ЭПР) – система пузырьков, цистерн и трубочек,
связанных между собой в единое внутриклеточное пространство, отделенное от
остальной части цитоплазмы замкнутой внутриклеточной мембраной. Эта сеть пронизывает
все цитоплазматическое пространство клетки и состоит из двух типов ЭПР –
шероховатого, покрытого рибосомами и гладкого, без рибосом. Главной функцией
эндоплазматического ретикулума первого типа является биосинтез (с помощью
рибосом), модификация и транспортировка белков. ЭПР второго типа обеспечивает
синтез липидов и полисахаридов. Мембраны ЭПР тесно взаимодействуют с различными
органеллами клетки, а также с ее плазматической мембраной и ядерной оболочкой,
в формировании которой при делении и росте клеток они принимают активное
участие.
|
 |
|
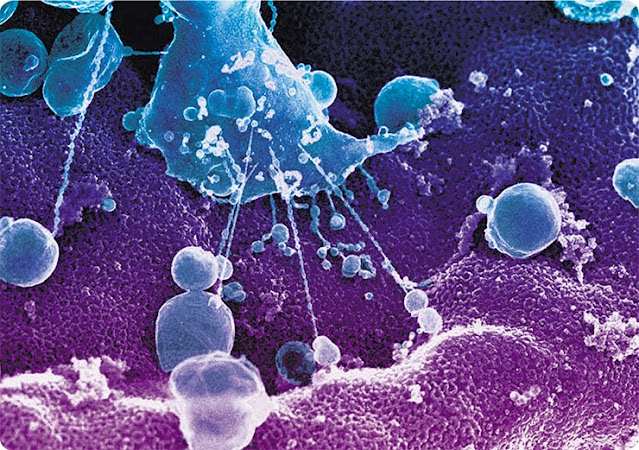
«Синий спрут».
Мембранные
компоненты эндоплазматического ретикулума на поверхности ядра, изолированного
из ооцита лягушки. Мембранные компоненты ЭПР (цистерны, пузырьки, трубочки)
принимают активное участие в сборке новых фрагментов ядерной оболочки растущих
неделящихся ядер. Мембраны ЭПР сливаются с наружной мембраной ядра, затем часть
мембран ЭПР перемещается на внутреннюю мембрану и сближается с наружными
мембранами, формируя новый участок ядерной оболочки.
|
В настоящее время разработаны более прямые методы получения трехмерного изображения. Один из них состоит в изучении образца в сканирующем электронном микроскопе (СЭМ), который обычно меньше и проще, чем просвечивающий электронный микроскоп.
 |
|
Цитоплазматическая
поверхность ядерной оболочки интерфазного ядра, выделенного из ранних эмбрионов
дрозофилы. Видны ядерные поры и пузырьки эндоплазматического ретикулума. Справа
внизу: Фрагмент содержимого ядра (нуклеоида) ооцита лягушки. Ядро выделили из
ооцита, затем осторожно убрали ядерную оболочку и получили желеобразный шарик –
нуклеоид, который сохраняет форму на короткое время, затем превращается в
уплощенный сгусток. Можно различить сеть внутриядерных филаментов и сферические
тельца.
|
Для получения изображения в просвечивающем электронном микроскопе используют электроны, проходящие через образец, а в сканирующем электронном микроскопе регистрируются электроны, рассеиваемые или излучаемые поверхностью образца. Для изучения в СЭМ образец должен быть зафиксирован, высушен и покрыт тонкой пленкой тяжелого металла. Затем образец сканируется узким пучком электронов. Отраженные и рассеянные при облучении образца электроны попадают в детектор, анализирующий полученную информацию, которая затем преобразуется в увеличенное изображение на экране.
 |
|
«Внутриядерные
рельсы».
Актинсодержащие
филаменты внутриядерного матрикса ооцита лягушки. После выделения ядра из
ооцита лягушки осторожно стеклянной иголкой отвернули фрагмент ядерной оболочки
и заглянули внутрь, сохранив контакты внутренней мембраны ядерной оболочки с
внутриядерным содержимым. До сих пор идут споры о том, что обеспечивает
распределение и организацию клеточных компонентов (хромосом, ядрышка,
сферических телец, рибонуклеопротеидных (РНП) частиц) внутри ядра. Отметим, что
в отличие от цитоплазмы все внутриядерные компоненты не имеют оболочек, тем не
менее многие процессы внутри ядра – компартментализованы, т. е. происходят,
например, только в ядрышке или в определенных сферических тельцах. А хромосомы
вообще занимают строго определенные области внутри ядра – так называемые
«хромосомные территории». Предполагается, что ведущую роль в этом процессе
выполняют ядерная оболочка и внутриядерный матрикс.
|
 |
|
«Неизвестная
планета».
Сферическое
тельце Кохала, содержащее белки для сплайсинга (удаление интронов из молекулы)
РНК, подвешенное на внутриядерных актинсодержащих нитях.
|
Метод сканирующей электронной микроскопии обеспечивает значительную глубину фокусировки. Более того, поскольку масштабы рассеивания электронов определяются углом поверхности по отношению к сканирующему лучу, то на изображении возникают чередующиеся светлые и темные участки, создающие впечатление трехмерности. А с появлением высокоразрешающего сканирующего автоэмиссионного электронного микроскопа (Field Emission in Lenz, фирмы Hitachi) ученым удалось получить уникальные трехмерные снимки цитоплазматической и внутриядерной поверхности ядерной оболочки, изучить тонкое строение ядерных поровых комплексов и заглянуть внутрь ядра.
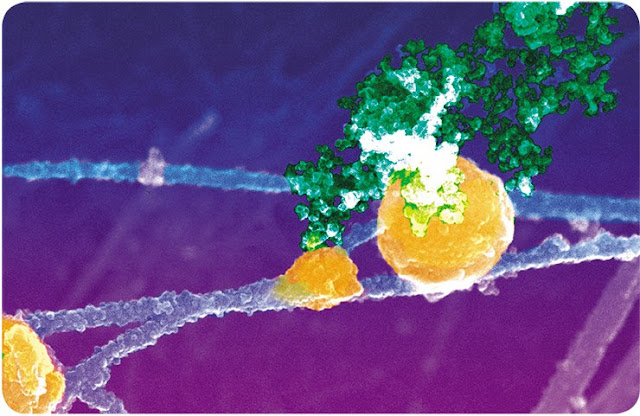 |
|
Контакт
хроматина (окрашен зеленым) с актинсодержащими филаментами и тельцем Кахала.
|
 |
|
Ядрышко, подвешенное на актинсодержащих нитях
внутри ядра
|
 |
|
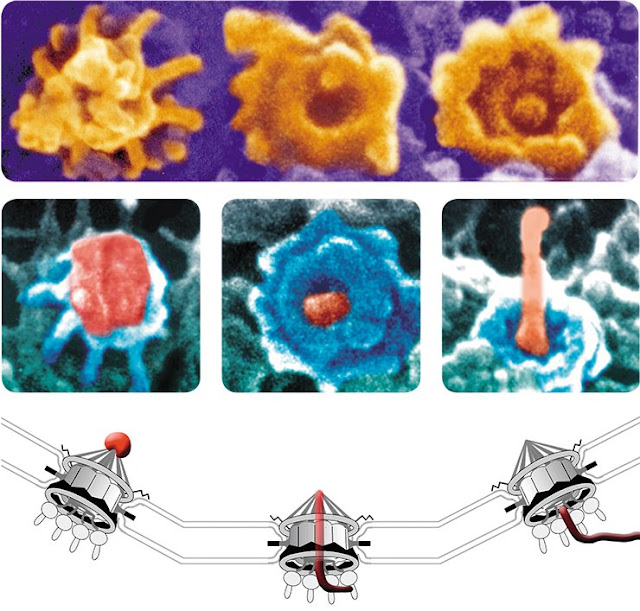
В процессе
транскрипции на ДНК, молекула мРНК сразу упаковывается с белками (их около
двадцати, они закручивают нить мРНК и покрывают ее защитной оболочкой) в РНП
фибриллу (нитку диаметром 10—20 нм), а затем в компактную РНП частицу
(диаметром от 30 до 50 нм). Это с одной стороны защищает молекулу РНК от
разрушения, а с другой обеспечивает ее эффективное перемещение внутри ядра.
Внутреннее пространство ядра достаточно плотно заполнено различными структурами
и молекулами. И в этом «столпотворении» мРНП частица должна переместиться к
ядерной поре, заякориться на ней и транспортироваться через центральный канал
поры в цитоплазму, где на ней должен начаться процесс трансляции – синтеза
белка. РНК-связанные белки играют большую роль в транспорте мРНК. Как показали исследования,
часть белков удаляется с РНП частицы, когда пора находится в баскет структуре,
а некоторые белки перемещаются с мРНК в цитоплазму и участвуют в процессе
трансляции. Удаление части белков приводит к тому, что РНП частица
разворачивается в более узкую РНП фибриллу, что обеспечивает ей эффективный транспорт
через центральный канал поры, диаметр которого при этом расширяется до 25
нанометров. Вверху: Три отдела
неактивной ядерной поры на большом увеличении: внутриядерный, центральный и
цитоплазматический компартменты (слева направо). В центре: активно функционирующая пора. Видно, как
рибонуклеопротеидная фибрилла (РНП фибрилла) проходит через различные
компартменты ядерной поры. Слева направо
показано, как РНП частица сначала заякоревается на верхушке баскета
внутриядерного компартмента и начинает разворачиваться в фибриллу, так как
размер канала ядерной поры меньше размера частицы. Затем мы видим фибриллу
(окрашено темнокрасным) в канале центрального компартмента поры. И, наконец, –
фибриллу РНП, выходящую из поры в цитоплазму. Внизу: схематическое изображение
того, что видно на верхних снимках – представлены три стадии прохождения РНП
фибриллы через разные отделы ядерной поры. Представленные снимки демонстрируют
высокую сложность организации ядерной поры – этой миниатюрной космической
станции, находящейся в глубинах живой клетки.
|
 |
|
Сборка ядерных поровых комплексов в участках
сплавления пузырьков ЭПР с наружной ядерной мембраной
|
 |
|
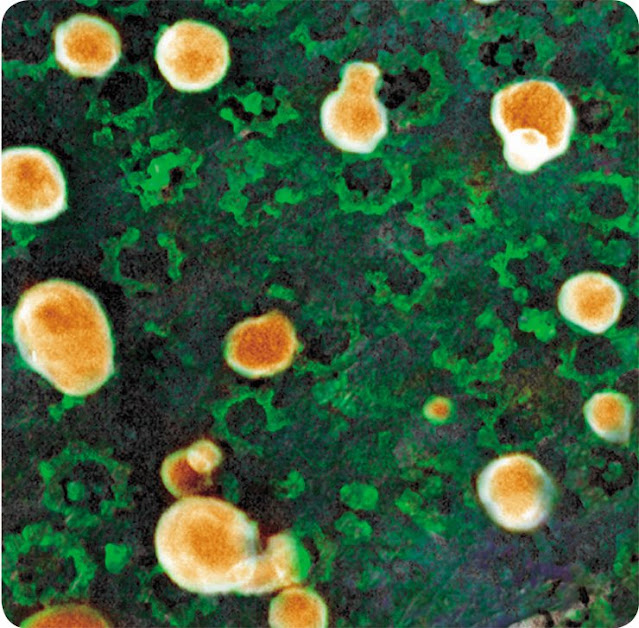
Цепочка мелких
пузырьков ЭПР, в сплавлении которых, возможно, принимает участие ретикулон 4,
на цитоплазматической поверхности ядерной оболочки ооцита лягушки.
|
 |
|
«Место встречи
изменить нельзя».
Локализация
белка ретикулона в участках слияния пузырьков эндоплазматического ретикулума.
Белки ретикулоны обнаружены во всех эукариотах и являются интегральными
мембранными белками, т. е. встроены в клеточные мембраны. Известны четыре гена,
кодирующиХ ретикулоны 1, 2, 3 и 4. В 2006 г. американскими исследователями было
установлено, что белок ретикулон 4 (NogoA в другой транскрипции) может изменять
кривизну мембран ЭПР в условиях in vitro (в пробирке) и превращать его
компоненты в микротрубочки. Мы впервые продемонстрировали в условиях in vivo,
что этот белок локализуется в участках сплавления компонентов (пузырьков) ЭПР
друг с другом, а также в участках сплавления компонентов ЭПР с наружной мембраной
ядерной оболочки. Это предполагает важную роль ретикулона 4 в сборке новых
фрагментов ядерной оболочки. Эти данные опубликованы нами в 2007 г. в J.
Struct. Biol. Поскольку этот белок принимает участие в развитии болезни
Альцгеймера (показано, что он ингибирует рост аксонов в нервных клетках), то
исследование функций этого белка представляет большой научный интерес.
|
E. Kiseleva
Все
представленные в этой публикации снимки получены с использованием
высокоразрешающего сканирующего электронного микроскопа фирмы Hitachi, на
котором работала автор в Институте раковых исследований им. Паттерсона, в г.
Манчестер (Англия), в рамках проекта по
исследованию структурной организации ядерной оболочки растущих неделящихся
ядер, таких как ооциты амфибий и интерфазных ядер ранних эмбрионов дрозофилы.














